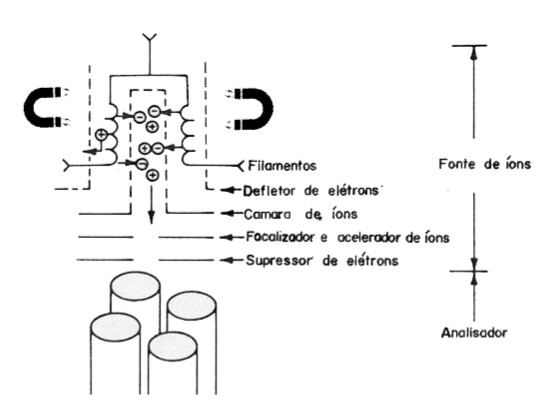
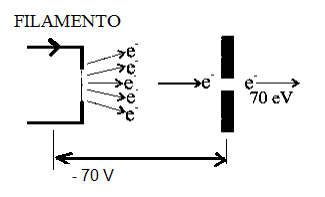
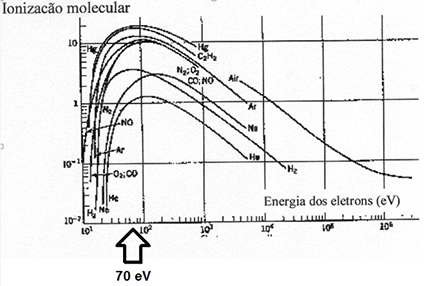
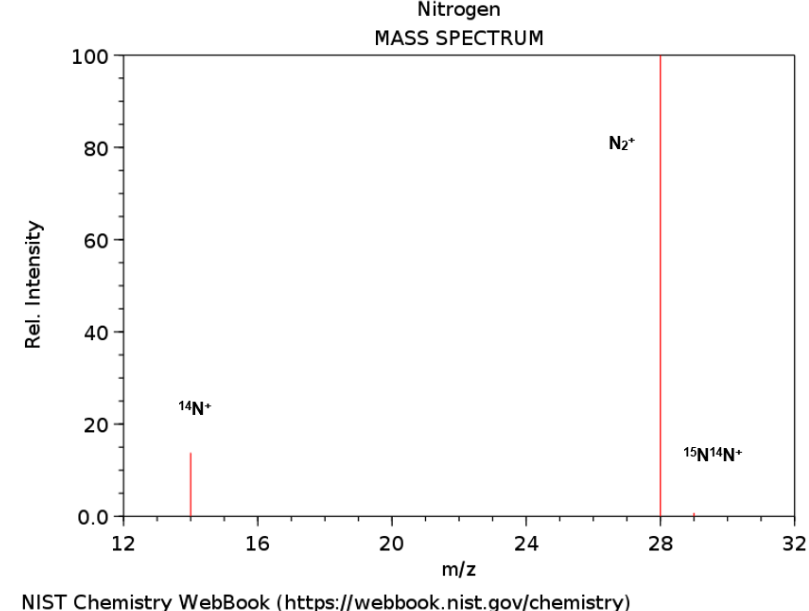
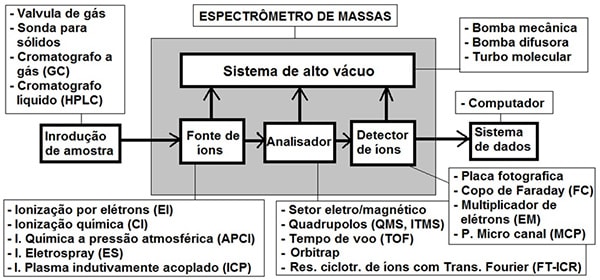
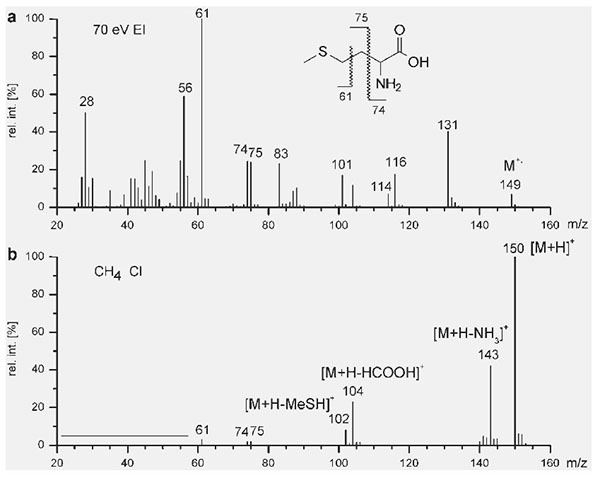
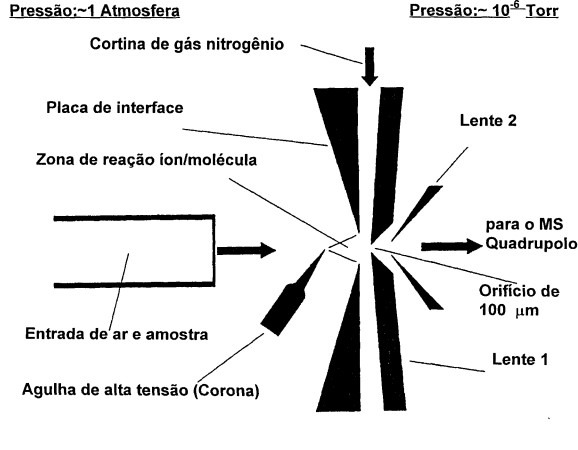
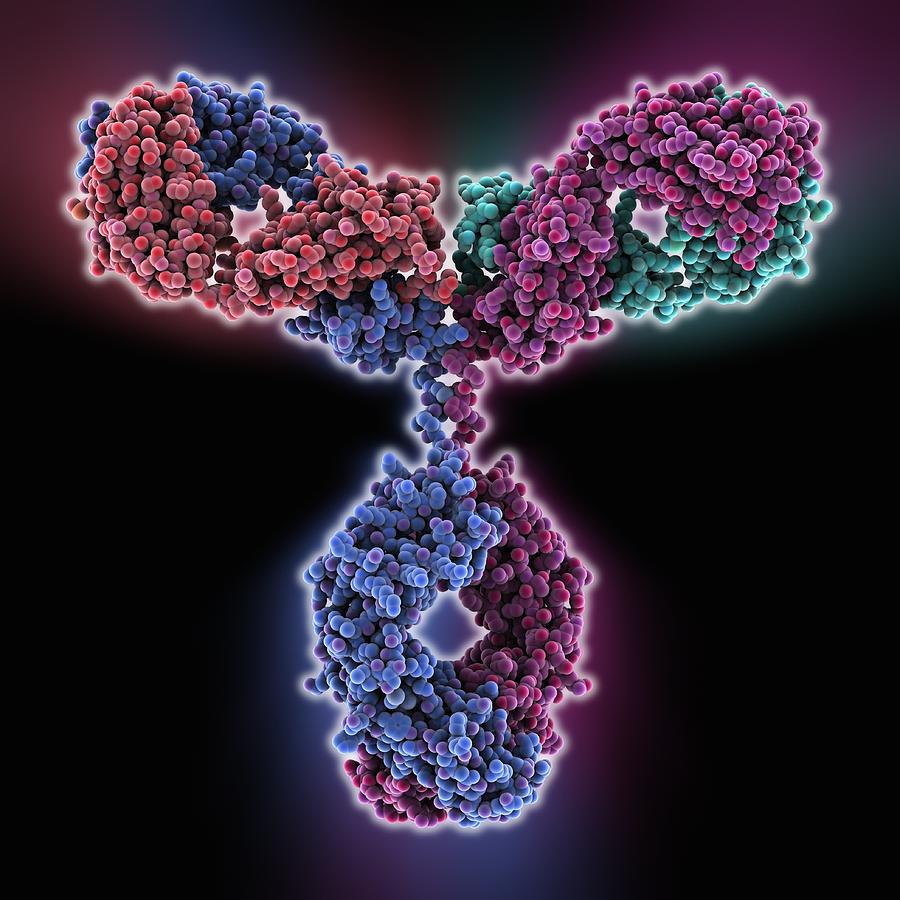
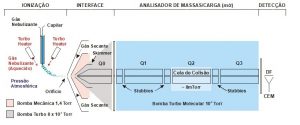
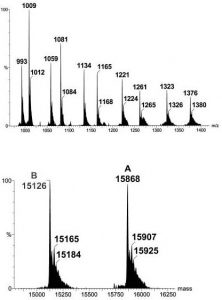
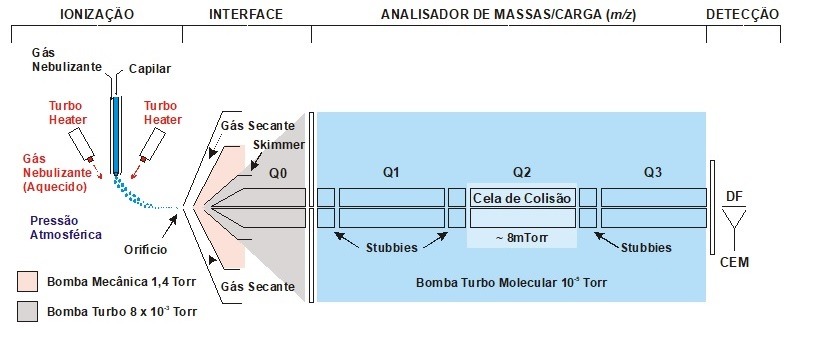
Na Edição 96 Revista Analytica, estão apresentadas as três seções que caracterizam o espectrômetro de massas: A fonte de íons, o analisador de massas de íons e o detector de íons. A ionização do analito ocorre na fonte de íons e os íons resultantes são contados no detector. Porém, é o analisador de massas que é responsável por discriminar e determinar a relação massa-carga (m/z) dos íons do analito. Portanto, o analisador de massas é o componente mais importante do espectrômetro de massa que coleta as massas ionizadas e as separa com base na razão m/z e as envia ao detector onde elas são detectadas. Em seguida são convertidas em uma saída digital. Logo, é o analisador que permite que o espectrômetro de massa atenda ao seu objetivo principal: determinar as massas dos analitos que estão sendo medidos. Por essa razão, a escolha do analisador depende das propriedades do analito após a ionização e dos requisitos do experimento que está sendo realizado.
Leia mais em REVISTA ANALYTICA ED 101
Por Oscar Vega Bustillos

Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP



 *Oscar Vega Bustillos
*Oscar Vega Bustillos