A espectrometria de massas e a química analítica

Por Oscar Vega Bustillos*
A espectrometria de massas é uma técnica analítica que qualifica e quantifica a matéria presente no universo. Consiste em analisar os átomos e moléculas por meio da relação massa/carga (m/z) dos íons de analitos no estado gasoso. A ciência que explora a espectrometria de massas é conhecida como “físico-química dos íons na fase gasosa”.
O estudo da espectrometria de massas envolve três itens principais: o instrumento analisador, denominado “espectrômetro de massas”, os resultados deste analisador, representados pelos “espectros de massas” e as “aplicações” em diferentes áreas da ciência que este analisador é utilizado.
O espectrômetro de massas é o instrumento analítico composto de um compartimento fechado à vácuo para não ter interferência com a atmosfera. Dentro do compartimento existem três seções que caracterizam o espectrômetro de massas: A “Fonte de íons” em que a amostra gasosa a ser analisada e convertida em íons. O “Analisador” em que os íons são separados e discriminados em função da sua razão massa/carga (m/z) e o “Detector de íons” em que os íons são detectados e transmitidos para um sistema de processamento de dados, resultando o espectro de massas. A Figura 1 apresenta as diferentes alternativas utilizadas no espectrômetro de massas. Estas alternativas dão a característica de aplicabilidade do espectrômetro de massas.
O espectro de massas consiste em um gráfico bidimensional, cujas coordenadas representam a razão (m/z) na abscissa, com unidade Dalton (Da), e na ordenada o número de íons detectados, representada em porcentagem (%) relativa ao íon mais intenso do espectro, conhecido como íon base. Por meio da leitura correta dos íons fragmentos do espectro de massas é possível deduzir a molécula em estudo.
A técnica pode ser aplicada em diversas áreas da ciência. Historicamente, a descoberta da estrutura da matéria, tais como a existência dos elétrons e dos isótopos da maioria dos elementos químicos da tabela periódica, foi possível graças à sua aplicação na ciência física e química, analisando algumas centenas de Daltons. Logo, com o desenvolvimento de novos instrumentos, a sua aplicação passou a ser explorada na ciência biológica, especialmente na medicina, analisando proteínas e outras moléculas de massa molecular acima de milhares de Daltons.
O desenvolvimento da espectrometria de massas é interessante e acompanha a evolução da inteligência humana. Quem inventou este analisador foi o físico inglês Joseph John Thomson (1856-1940) no ano de 1897. Certamente ele “subiu nos ombros dos gigantes”, tal como Newton sugere, para descobrir novos avanços na ciência. Os gigantes que J.J. Thomson “subiu” foram: Otto von Guericke (1602-1686) físico alemão que em 1650 descobre novas maquinas para gerar vácuo. Michael Faraday (1791-1867) e James Maxwell (1831-1879) foram outros gigantes que abriram o caminho para compreensão do eletromagnetismo. Faraday desenvolveu a eletroquímica e definiu termos importantes na espectrometria de massas, tais como ânodo, cátodo e íons positivos e negativos. Maxwell formulou a teoria do eletromagnetismo, fornecendo base da espectrometria de massas, onde os íons, no interior do analisador de massas, são separados e discriminados em função a sua razão m/z.
Mas um dos gigantes que impulsionou o descobrimento da espectrometria de massas foi o físico britânico William Crookes (1832-1919) que desenvolveu o “Tubo de Raios Catódicos”. Este instrumento era um tubo de vidro fechado à vácuo com dois eletrodos metálicos, onde era aplicada correntes elétricas positivas e negativas. O efeito produzia um feixe de luz visível esverdeada. Várias experiências foram realizadas pelos pesquisadores com este tubo. Uma delas foi realizada pelos físicos alemães Johann Hittorf e Julius Plucker, em 1869, conseguindo deslocar o feixe de luz visível esverdeada por meio de um imã externo ao tubo de vácuo.
Esta experiência com o Tubo de Raios Catódicos empolgou o pesquisador J.J. Thomson que, ao modificar a geometria deste tubo, desenvolveu o primeiro espectrômetro de massas. As partes do primeiro espectrômetro são equivalentes às já enunciadas anteriormente: fonte de íons, analisador e detector. Como detector foi utilizado uma placa fotográfica para registrar o caminho ótico dos íons, obtendo geometrias parabólicas. A matemática na espectrometria de massas está presente já que a geometria do caminho dos íons é de suma importância para interpretação dos espectros de massas. Por meio do primeiro espectrômetro de massas, J.J. Thomson consegue medir a relação massa/carga do elétron que, então, não era conhecido, denominando “partícula corpuscular”. Naquela época, acreditava-se que o átomo era uma partícula indivisível, tal como o grego Demócrito formulou no ano 400 a.C. (“a” significa “sem” e “tomo” significa “divisão” em grego). O físico inglês John Dalton (1766-1844) reforçou esta teoria postulando em 1803 que “Toda matéria, sólida, líquida ou gasosa consiste de um grande número de pequenas partículas denominadas átomos. Nenhum processo químico poderá criar ou aniquilar os átomos”. Em homenagem a esta teoria a unidade da razão massa/carga é chamada de Daltons.
Além do elétron, J.J. Thomson e seu aluno Francis William Aston (1877-1945) descobrem os isótopos 20Ne e 22Ne do gás Neônio. Foi assim que na reunião da Real Academia de Ciência na Inglaterra no ano de 1897, J.J. Thomson anuncia que o átomo é uma partícula divisível. Ele chegou a esta conclusão após verificar que a massa da partícula corpuscular descoberta (elétron) era menor que a massa do elemento mais leve da tabela periódica, o Hidrogênio. Esta descoberta deixou eufórica à comunidade científica. A primeira pergunta da plateia para o Professor Thomson foi: Como ele concebia o modelo atômico? Ele responde que o átomo era como um pudim inglês, onde as uvas passas estão localizadas no lado externo e ao redor do pudim. Certamente a resposta de Thomson foi pronunciada antes da hora do banquete da academia influenciando, desta forma, no primeiro modelo atômico. Pela descoberta dos elétrons, J.J. Thomson recebeu o premio Nobel de Física de 1906.
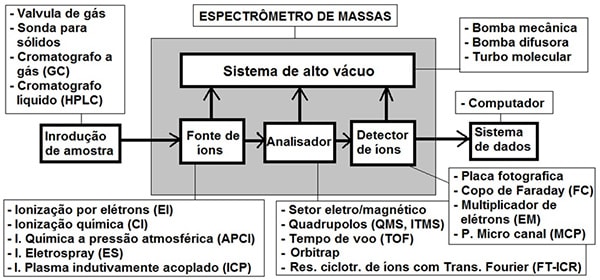
Figura 1: Diagrama das diferentes técnicas alternativas utilizadas no espectrômetro de massas.
Referências bibliográficas
- Ricardo Vessecchi; Norberto Peporine Lopes; Fábio Cesar Gozzo; Felipe Augusto Dörr; Michael Murgu; Daniel Temponi Lebre; Renato Abreu; Oscar Vega Bustillos; José Manuel Riveros. “Nomenclaturas de espectrometria de massas em língua portuguesa”. Quím. Nova vol.34 no.10 São Paulo 2011.
*Oscar Vega Bustillos
Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP
55 11 3133 9343


