Por Oscar Vega Bustillos*
A técnica de ionização química (CI Chemical Ionization), introduzida por Burnaby Munson e Frank H. Field em 1966, é uma consequência direta dos estudos fundamentais da interação íon/molécula. A espectrometria de massas por ionização química (CI-MS) tornou-se uma ferramenta poderosa e versátil para a identificação e quantificação de moléculas orgânicas. Possui uma ampla aplicação em muitos ramos da química, bioquímica e ambiental.
Este método de criação de íons é normalmente denominado de ionização “suave” quando comparada à ionização por impacto de elétrons (EI electron ionization). A ionização química produz íons da amostra neutra sem depositar considerável quantidade de energia nos íons formados, em torno de 1 a 4 eV. Em contra partida a energia interna responsável pela extensiva fragmentação dos íons criados na ionização por impacto de elétrons é de 70 eV. Isto é uma técnica de ionização “forte”. Embora os padrões de fragmentação sejam de considerável utilidade analítica, o íon molecular é de extrema importância. Muitos espectros de EI não contêm mais do que um traço do íon molecular ou até ficam ausentes. Em contrapartida, os espectros de CI fornecem, em muitos casos, um intenso íon molecular e um padrão de fragmentação muito mais simples.
Na Figura 1 é apresentada a comparação dos espectros de massas obtidos via EI e CI da molécula Metionina C5H11NO2S cuja massa molecular é 149 g mol-1. No espectro de EI o íon molécula (m/z 149) está presente com intensidade relativa iônica menor que 10%. Pelo contrario no espectro de CI o íon molécula protonado [M+H]+ está com intensidade relativa iônica de 100% e com pouca fragmentação comparada com o espectro EI. Na figura 1a é apresentada a molécula Metionina e suas massas fragmentadas obtidas com um software muito útil para o espectrometrista chamada ChemOffice.
Na prática a ionização química acontece em dois passos diferentes. No primeiro um gás reagente (metano, isobutano ou amônia) é introduzido na fonte de íons mantida à vácuo (10-5 mbar) e ionizado por meio de impacto de elétrons com 70 eV de energia, formando íons do gás reagente. No segundo passo, as moléculas da amostra a serem analisadas são introduzidas na mesma fonte de íons, mas sem impacto de elétrons e com pressão superior à anterior (10-3 mbar), onde acontece a ionização química pela interação com os íons do gás reagente. Na ionização química de íons positivos, uma das reações mais utilizadas, tem sido a transferência de prótons dos íons reagentes (BH+) para a molécula da amostra M (Ver reação 1), onde ΔH corresponde a diferença de protoafinidade de B menos a protoafinidade de M. Para que tal reação ocorra, a mesma deve ser exotérmica (ΔH negativo). Isto implica que a protoafinidade do íon reagente (BH+) deve ser menor que a protoafinidade da molécula de interesse M.
BH+ + M → [M+H]+ + B (ΔH) (1)
A magnitude de ΔH e, em consequência, a extensão da fragmentação de MH+ pode ser controlada pela escolha correta do gás reagente. Conceitualmente, a protoafinidade (P.A.) de uma molécula pode ser entendida como a quantidade de energia liberada quando da adição de um próton a esta. Portanto, uma grande protoafinidade (P.A.) significa que mais energia é liberada quando da adição de um próton e, desta forma, a adição de um próton se torna energeticamente mais favorável. Cabe salientar que as reações de transferência protônica são altamente eficientes, ocorrendo virtualmente em todas as colisões. Caso a protoafinidade (P.A.) do íon reagente seja maior do que a da molécula de interesse, sua eficiência cairá e tornar-se-á muito baixa para reações endotérmica ou endoenergéticas. Portanto, o principal parâmetro na CI reside na escolha correta do gás reagente cuja protoafinidade deve ser previamente conhecida (Ver equação 2). A CI é muito utilizada nos analisadores GC/MS já que a fonte de íons é acoplada a injetores de gases reagentes.
P.A. (gás reagente) < P.A. (analito) (2)
A ionização química é tão seletiva que pode ser realizada numa fonte de íons com pressão atmosférica sem que as moléculas da atmosfera (nitrogênio, oxigênio e umidade) interferem na ionização. Este foi uma experiência única onde uma agulha de tesla (corona) gera elétrons que ioniza a umidade atmosférica gerando os íons de hidrônio H3O+ sendo estes íons doadores protônicos para as moléculas dos analitos de interesse, especialmente os hidrocarbonetos mais conhecidos na química da atmosfera como Compostos Orgânicos Voláteis (COVs). O espectrômetro de massas que realiza estas análises é denominado como PTR-MS (Proton Transfer Reaction Mass Spectrometry).
A ionização química a pressão atmosférica APCI-MS (Atmospher Pressure Chemical Ionization Mass Spectrometry) é muito utilizado nas análises químicas de macro moléculas, além de ser a primeira seção do espectrometro de massas a ser liberada da dependência de um sistema de vácuo (Figura 2). Certamente, com este desenvolvimento foram dados prêmios Nobel para os autores de este feitio. Provavelmente, o cientista que deseja ganhar um prêmio Nobel terá que desenvolver um analisador e um detector do espectrômetro de massas, que não dependam do vácuo.
As vantagens da ionização CI são: Identifica o íon molécula protonado com alta intensidade. Análise reprodutiva. Baixa fragmentação da molécula do analito. Interfaceamento com o cromatógrafo a gás (GC). Não é imprescindível um sistema de alto vácuo para geração de íons protonados. Gera íons a pressão atmosférica.
As desvantagens da ionização CI são: Não há uma libraria de espectros de massas. A amostra tem que ser volátil. Depende da protoafinidade do gás reagente.
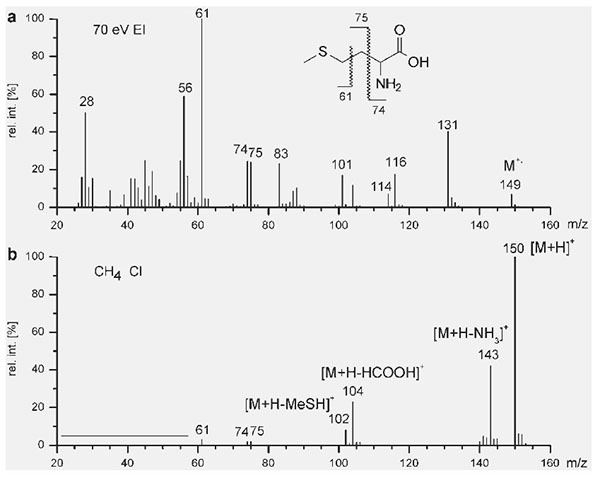
Figura 1: Espectros de massas da Metionina C5H11NO2S (M.W. 149). a) Obtida por Ionização por Elétrons (EI) com energia de 70 eV, observa-se o íon molécula M+. (m/z 149) com baixa intensidade. b) Obtida por Ionização Química (CI) usando Metano como gás reagente, observa-se o íon molécula protonado [M+H]+ (m/z 150) com elevada intensidade, além de menor fragmentação iônica (Fonte: Gross, J.H. Mass Spectrometry)
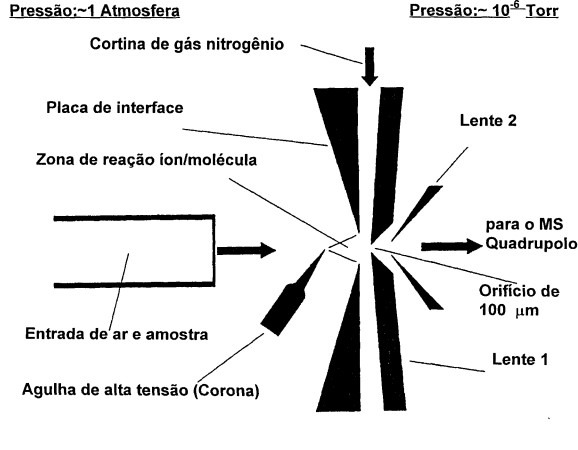
Figura 2. Diagrama esquemático da fonte de íons APCI-MS (Fonte: Bustillos, O.V.)
Referências bibliográficas
- Gross, J.H. Mass Spectrometry. A Tex Springer. Berlin. 2004.
- Harrison, A.G. Chemical Ionization Mass Spectrometry. CRC Press. Toronto. 1992.
- Bustillos, O.V. Procedimento analítico aplicado ao estudo de gases provenientes da combustão de metanol por automóvel. Tese IPEN. 2003.
*Oscar Vega Bustillos
Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP
55 11 3133 9343
www.vegascience.blogspot.com.br







