Por Oscar Vega Bustillos*
Átomos e moléculas no estado gasoso são de difícil manipulação no laboratório, somente suas pressões podem ser variadas. Uma vez que estes átomos e moléculas são ionizados, os íons produzidos podem facilmente ser controlados por campos eletromagnéticos. A espectrometria de massas analisa a relação massa/carga destes átomos e moléculas por meio da manipulação de trajetórias iônicas dentro de campos eletromagnéticos.
O compartimento físico onde é realizada a ionização das moléculas neutras do analito a ser estudado por espectrometria de massas é conhecido como “Fonte de íons”, que também qualifica o instrumento para sua finalidade analítica.
Uma das técnicas para ionizar átomos e moléculas na espectrometria de massas pode ser por impacto de elétrons ou EI (Electron Ionization). A mesma requer que a fonte de íons esteja em alto vácuo para não ter interferência com as moléculas da atmosfera do laboratório. Nesta técnica, elétrons liberados por um filamento aquecido, colidem com moléculas gasosas que entram na fonte de íons. O produto da colisão elétron-molécula é um íon positivo ou negativo num estado eletrônico vibracional excitado.
Os íons foram descobertos por Michel Faraday em 1830, quando trabalhava com células eletroquímicas. Ele verificou que um grupo de moléculas, carregadas negativamente, viajava em direção ao anodo da célula e outro grupo de moléculas, carregadas positivamente, viajava em direção ao catodo. Estas moléculas carregadas, positivamente ou negativamente, Faraday deu o nome de “íons”, que em grego significa “viajantes”.
Curiosamente, quem descreveu o mecanismo dos íons foi o químico sueco Svante Arrehenius na sua tese de doutorado em 1884. Ele estudou as propriedades condutoras das dissoluções eletrolíticas; sua tese foi muito criticada pela banca examinadora e foi aprovada com a menor nota na Universidade de Uppsala. Em 1903 a mesma tese ganhou o Premio Nobel de química em reconhecimento aos extraordinários serviços prestados no avanço da química por meio de sua teoria da dissociação eletrolítica.
Assim, o íon positivo é todo átomo ou molécula que perdeu um ou mais elétrons da sua camada eletrônica externa e o íon negativo é todo átomo ou molécula que ganhou um ou mais elétrons na sua camada eletrônica.
O canadense-americano Arthur Dempster, em sua tese publicada em 1916, utilizou pela primeira vez a técnica de ionização por impacto de elétrons. Dempster explica como acontece este fenômeno: Quando uma corrente elétrica é aplicada a um filamento, o mesmo será aquecido pelo efeito Joule até a incandescência, emitindo elétrons como mostra a Fig.1A. Um potencial de aproximadamente 70 V é mantido entre o filamento e a placa colimadora de tal forma que os elétrons sejam acelerados com uma energia média de 70 eV. Estes elétrons interagem com as moléculas neutras do analito tornando-as íons positivos e negativos. Na fonte de íons são instalados dois imãs permanentes criando um caminho helicoidal dos elétrons energizados, aumentando a probabilidade de interação com as moléculas neutras, acrescendo assim o número de íons na fonte (Fig.1B).
O valor de 70 eV é comum, porque a probabilidade de ionização, para muitos compostos, é maximizada próximo deste valor, como pode ser visto na Fig. 2A. A produção de íons diminui para valores maiores de 70 eV devido às reações íon-molécula no interior da fonte de íons.
Como exemplo, a ionização do gás nitrogênio (N2) por impacto do elétron primário, ep–, faz com que a molécula, em seu estado fundamental, seja elevada a energias maiores e escapando do poço de potencial da molécula neutra. Um elétron secundário es–, é também liberado pela molécula de nitrogênio, tal como é descrito na seguinte equação.
![]()
O impacto do elétron primário pode também aumentar a energia vibracional do cátion resultante, que tem uma função importante na espectrometria de massas. Na medida em que a razão de vibração e o alongamento da ligação aumentam, a probabilidade de rompimento da ligação também aumenta. A ruptura da ligação resulta na fragmentação do íon precursor, como se fosse uma taça de cristal que se quebra ao cair no chão. Na investigação de moléculas gasosas por espectrometria de massas, observa-se frequentemente que a magnitude dos fragmentos detectados é muito maior que a do íon precursor, conhecido como íon molécula. O padrão de fragmentação depende da composição do íon precursor e o exame do padrão de fragmentação leva a uma compreensão da estrutura e composição do íon precursor. Para o nitrogênio a única fragmentação possível é o íon N+. Neste ponto, a ionização por EI do analito nitrogênio esta completa e os íons N2+, N+ e a contribuição isotópica 15N14N+ devem ser agora direcionados para o espectrômetro de massas onde serão discriminados segundo a razão m/z (Fig.2B).
Na fonte de ionização por impacto de elétrons produz 70% de íons positivos e o restante de íons negativos. Isso ocorre porque existe uma probabilidade maior de arrancar elétrons das moléculas neutras. Um pequeno percentual, menor que 0,01%, dos íons positivos produzidos na fonte, são transferidos para dentro do analisador do espectrômetro de massas quadrupolar (Fig.2B).
A ionização por EI geralmente é utilizada em interfases, como a da cromatografia a gás acoplada a espectrometria de massas GC/MS, ou na ionização de sondas com amostra sólida. As amostras podem ser sólidas, liquidas ou gasosas, a única condição, que sejam voláteis. Esta técnica de ionização é considerada uma ionização “forte” já que produz, além do íon molécula ou íon precursor, vários fragmentos iônicos conhecidos como íons produtos, que descrevem fielmente a estrutura molecular do analito em estudo.
O espectro de massas, gerado pela ionização por impacto de elétrons das moléculas em estudo, é reprodutivo, equivalente à impressão digital molecular, condicionado somente pela energia dos elétrons de ionização de 70 eV. Graças a este fenômeno, no ano de 1969, foi gerado um banco de dados de espectros de massas da maioria das moléculas químicas voláteis pela agencia americana NIST (National Institute of Standards and Technology). A maioria dos analisadores de GC/MS é comercializada com um banco de dados da NIST.
As vantagens da ionização EI são: Análise reprodutiva. Alta eficiência de ionização. A ionização não é seletiva. Elevada fragmentação da molécula descrevendo a estrutura molecular do analito. Interfaceamento com o cromatógrafo a gás (GC). Banco de dados de espectros de massas que facilita a identificação e estrutura do analito.
As desvantagens da ionização EI são: A amostra tem que ser volátil. A ionização cria alta energia interna na molécula do analito. Não pode ser interfaceada com a cromatografia líquida (LC). Os rearranjos iônicos dificultam a interpretação do espectro de massas. A análise é limitada para analitos com massas moleculares inferiores a 600 Daltons. Elevado fracionamento molecular complica a leitura do espectro de massas. É imprescindível um sistema de alto vácuo para geração de íons.
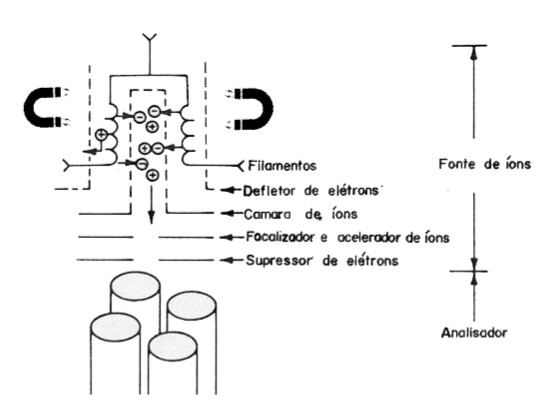
Figura 1 A: Um filamento emissor de elétrons com energia 70 eV.
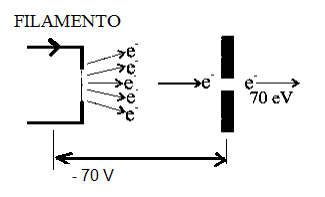
Figura 1 B Fonte de íons por impacto de elétrons gerando íons positivos e negativos. Em destaque os imãs permanentes utilizados para produzir maior número de íons.
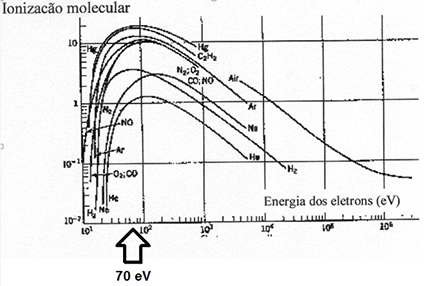
Figura 2 A Energia de elétrons requerida para ionização de gases. Note que para a maioria dos gases, elétrons com energias de 70 eV produzem um número máximo de moléculas gasosas ionizadas.
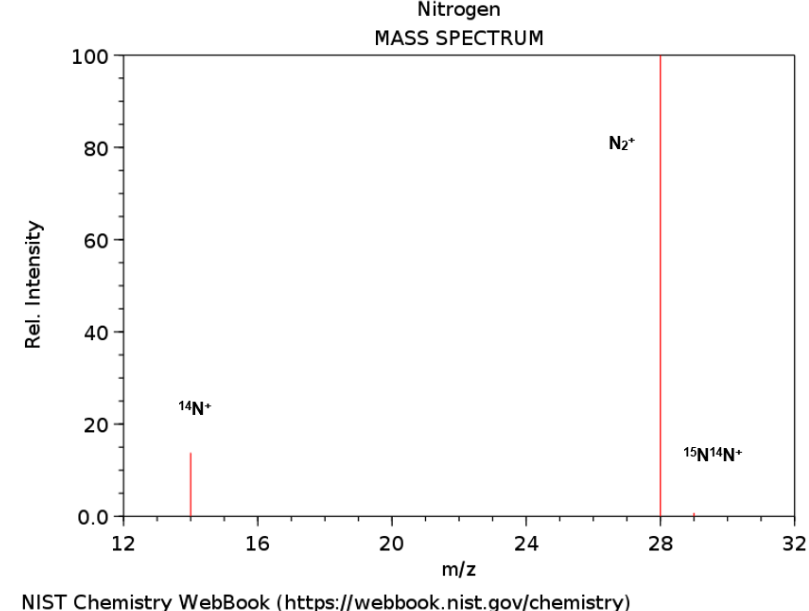
B) Espectro de massas do gás nitrogênio gerado via ionização de elétrons, apresentam os íons N+ (m/z=14), N2+ (m/z=28) e a contribuição isotópica 15N14N+ (m/z=29).
Referências bibliográficas
- Stenhagen, E., Abrahamsson, S. e McLafferty, F.W. Atlas mass spectral data. Vol. 1, 2 e 3. John Wiley and Sons. New York. 1969.
- Bustillos, O.V., Sassine, A., March, R. A espectrometria de massas quadrupolar. 1ª. Edição. Scortecci editora, São Paulo. 2003.
*Oscar Vega Bustillos
Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP
55 11 3133 9343
www.vegascience.blogspot.com.br







