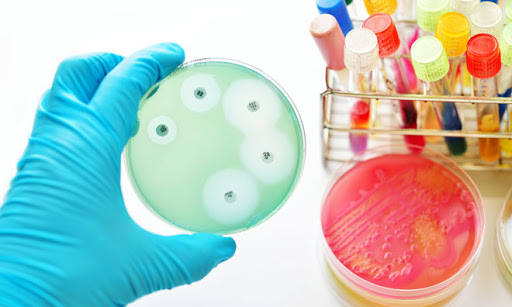
Como sabemos a qualidade microbiológica dos produtos farmacêuticos é de extrema importância para que se possa assegurar a sua segurança, eficácia e potência para os pacientes que necessitam fazer uso dos produtos
A garantia da qualidade e o controle de fabricação previstos nas boas práticas devem garantir que o produto cumpra as especificações determinadas, isto é, que atendam além de outros parâmetros, aos limites aceitáveis para micro-organismos.
A seleção dos fornecedores e a adoção das Boas Práticas de Fabricação e Controle garantem a qualidade dos produtos farmacêuticos através do controle de qualidade microbiológico e o o monitoramento ambiental microbiológico . No entretanto, a realização dos testes microbiológicos não apresenta a garantia absoluta da ausência dos microrganismos indesejáveis tais como as bactérias, vírus, fungos etc.
A confiabilidade dos métodos microbiológicos deve ser demonstrada através dos controles realizados em cada etapa de produção e a amostragem adequada. Todos sabemos porém , que estes métodos tem baixa precisão e grande variabilidade quando comparado a outros métodos métodos analíticos , justamente por se tratar de métodos biológicos.
A seleção e planejamento do método microbiológico com níveis de precisão e exatidão aceitáveis devem ser fazer parte da estratégia de validação pela equipe de qualidade.
Os métodos microbiológicos são descritos nos compêndios , tais como a Farmacopéia Brasileira e outras farmacopeias e não necessitam ser validados. Porém , as empresas farmacêuticas devem demonstrar através de um protocolo e documentação que o laboratório de controle microbiológico tem um sistema de qualidade adequado e que o método é confiável apresentando dados de precisão e exatidão, como descritos na farmacopeia.
A empresa deve apresentar a “Adequabilidade do método”, através da qualificação do produto farmacêutico sendo submetido ao desafio com a adição dos contaminantes bacterianos citados nas farmacopeias e os microrganismos isolados do ambiente utilizados como controles positivos para demonstrar que a matriz do produto não interfere na detecção dos mesmos e afeta o resultado da análise.
Exemplos de adequabilidade dos métodos ; teste de bacteriostase e fungistase para os testes de esterilidade, e determinação da contagem microbiana de produtos e biocarga.
Resultados de contagem microbiana com variação de 50 a 200% são aceitáveis na determinação das Unidades Formadoras de Colônias nos métodos de contagem microbiana devido a variabilidade inerente ao método.
Na realização dos testes de adequabilidade de contagem microbiana e pesquisa de microrganismos indesejáveis devemos utilizar que as cepas de controles positivos apresentem contagem inferior a 100 Unidades Formadoras de Colônias. Para adequação dos métodos farmacopeicos aos produtos não estéreis deve ser demonstrada a eliminação de qualquer propriedade antimicrobiana antes da verificação da existência de contaminação microbiana nos produtos.
O protocolo do teste de adequação deve mimetizar o teste de limite microbiano o preparo da amostra, tipo de meio de cultura e soluções tampão, número e tipo da solução de lavagens das membranas bem como as condições de incubação. Esse protocolo requer o uso de micro-organismos para o teste de recuperação microbiana.
Durante a adequação, demonstrar que a escolha do método para estimativa qualitativa e/ou quantitativa dos micro-organismos viáveis é sensível, exato e confiável e que é capaz eliminar qualquer interferência ou inibição durante a recuperação dos micro-organismos viáveis.
Revalidar o método de adequação se forem modificadas as condições de ensaio e/ou ocorrerem alterações no produto que possam afetá-lo.
Referencias bibliográficas
- Farmacopéia Brasileira 6º edição capítulo 5.5.3
- Farmacopéia dos Estados Unidos da América USP 43 , cap. <1227> “Validation of Microbial Recovery from Pharmacopeial Articles”.

*Claudio Kiyoshi Hirai é farmacêutico bioquímico, diretor científico da BCQ consultoria e qualidade, membro da American Society of Microbiology e membro do CTT de microbiologia da Farmacopeia Brasileira. Telefone: 11 5539 6719 E-mail: técnica@bcq.com.br