Por Oscar Vega Bustillos*
A espectrometria de massas (MS) é uma técnica analítica conhecida por sua excelência na discriminação de átomos e moléculas, baseada na medida das razões massa/carga (m/z). Mas tem a desvantagem de não ser excelente na separação de isômeros, isto é, distinguir moléculas com mesma massa molecular. Neste caso estão incluídos os enantiomeros, que são moléculas que possuem estruturas e propriedades distintas, porem apresentam exatamente a mesma massa.
Com o rápido crescimento do mercado de drogas enantioméricas puras e moléculas bioativas, novas ferramentas analíticas quirais seletivas foram exploradas. Embora a MS seja uma das melhores ferramentas analíticas, que tem sido usada de forma eficiente em diversas aplicações farmacêuticas e biológicas, tradicionalmente a MS é considerada uma técnica “quiral ‐ cega”. Essa limitação ocorre devido à incapacidade de o MS diferenciar entre dois enantiômeros de uma molécula quiral com base apenas em suas massas. Uma das drogas enantiométricas é a talidomida, devido a seus efeitos teratogénicos, tal substância deve ser evitada durante a gravidez humana pois pode causar má-formação no feto. A talidomida é um derivado do ácido glutâmico e estruturalmente contém dois anéis amida e um único centro quiral. Este composto existe na forma de mistura equivalente dos isómeros (S)(-) e (R)(+) que se interconvertem rapidamente em condições fisiológicas. O enantiómero (S) está relacionado com os efeitos teratogénicos, enquanto o enantiómero (R) é responsável pelas suas propriedades sedativas.
Várias abordagens foram exploradas para avaliar o papel potencial da MS na análise quiral. A primeira abordagem depende do uso de técnicas de hifenização utilizando ferramentas de separação quiral rápidas e sensíveis, como cromatografia líquida (LC), cromatografia gasosa (GC) e eletroforese capilar (CE) acoplada ao detector MS. Uma dessas técnicas hifenadas é GC/GC-TOF utilizada para caracterizar os Compostos Orgânicos Voláteis Biogênicos no estudo da química da atmosfera (N. Zanoni, 2020). Mais recentemente, a espectrometria de mobilidade iônica foi introduzida para avaliar qualitativa e quantitativamente os compostos quirais.
A espectrometria de mobilidade iônica (IMS) oferece uma separação baseada não apenas na massa e na carga, mas também no formato dos íons. Assim, ela possui a habilidade de resolver isômeros com diferentes geometrias espaciais, expressas pela secção de choque. Sua combinação com a MS gerou, desse modo, uma ferramenta analítica poderosa para a caracterização e resolução de íons, incluindo isômeros.
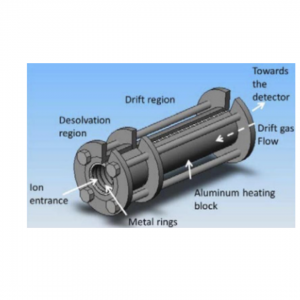
Em um espectrômetro de mobilidade iônica, moléculas orgânicas são ionizadas e conduzidas por um campo elétrico contra um contrafluxo de gás de deriva neutro. Em seu caminho para o detector, os íons colidem várias vezes com o gás de deriva reduzindo sua velocidade. Após cada colisão, os íons são acelerados novamente pelo campo imposto. A alternância de acelerações e as colisões resultam em uma velocidade média constante de íons que depende das suas cargas, massa e seção transversal de colisão (Figura 1).
O espectrômetro de mobilidade iônica acoplado a espectrometria de massas (IMS/MS) funciona em três etapas básicas (Figura 2). Na primeira etapa, íons são gerados por uma fonte de íons à pressão atmosférica, a partir dos analitos a serem estudados. Na segunda etapa os íons são separados de acordo com sua mobilidade através de um gás tampão em uma escala de tempo de milissegundos, num tubo de derivação de íons mantido num gradiente de campo elétrico uniforme (IMS). Na terceira etapa, os íons separados são então introduzidos em um analisador de massas (MS), onde sua razão massa/carga pode ser determinada em uma escala de tempo de microssegundos.
Vários métodos de ionização são utilizados no IMS para converter moléculas do analito em íons. Entre estes estão: fonte radiativa de 63Ni (igual a utilizada no “Electron Capture Detector- ECD” inventada por James Lovelock), fotoionização, ionização a Laser e ionização por “Electrospray”. A fonte de Electrospray é ideal para amostras líquidas e não voláteis de alto peso molecular. O Electrospray é uma fonte de ionização suave que produz espectros simples sem fragmentação, onde o peso molecular pode ser facilmente determinado durante o acoplamento com o IMS. O uso de Eletrospray no IMS como um dispositivo de separação e detecção foi demonstrado para explosivos, produtos de degradação de guerra química e amostra biológicas.
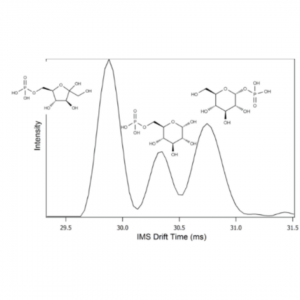
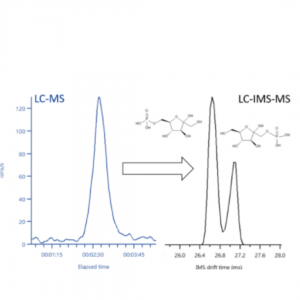
Os espectros de IMS/MS são gráficos de intensidade de picos de íons vs. tempo de deriva no eixo x. A Figura 3 mostra um espectro típico de mobilidade dos íons dos fosfatos de açúcar isoméricos: frutose-6-fosfato, glicose-6-fosfato e glicose-1-fosfato, com estruturas moleculares diferentes. Os fosfatos de açúcar estão envolvidos em importantes processos metabólicos via glicólise ou via da pentose fosfato. Devido à sua natureza isomérica, muitos deles não podem ser distinguidos usando LC ou MS/MS. No entanto, a concentração do fosfato pode fornecer informações cruciais sobre as estatísticas metabólicas de um sistema. A Figura 4, mostra a análise da molécula C6H13O9P via UHPLC-MS usando uma coluna cromatográfica HILIC, apresenta apenas um único pico, como mostra a figura à esquerda. A figura à direita mostra a análise do mesmo analito extraído do pico de LC-MS mas via IMS/MS. A presença de duas substâncias isoméricas é observada: a da frutose-1-fosfato e da frutose-6-fosfato.
As vantagens da IMS são as seguintes: opera à pressão atmosférica, ionização eficiente para moléculas orgânicas, seletividade baseada na protoafinidade, separação com base na seção de choque, equipamento portátil, resposta em milisegundos e prático acoplamento com o MS.
As desvantagens são as seguintes: Gera espectro complexo devido a interferência de sinais espúrios, não é apropriado para analitos não voláteis e requer eletrônica de alta velocidade.
Fonte: M.D.Katiuska
Figura 1: Espectrômetro de mobilidade iônica (IMS).
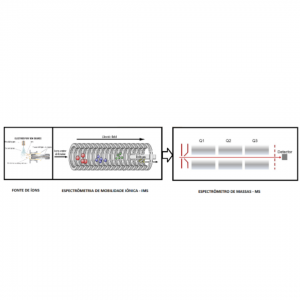
Figura 2: O espectrômetro de mobilidade iônica acoplado a espectrometria de massas (IMS/MS). 1) Fonte de íons à pressão atmosférica. 2) Os íons são separados de acordo com sua mobilidade através de um gás tampão, os íons são mantidos num gradiente de campo elétrico uniforme (IMS). 3) Os íons separados são então introduzidos em um analisador de massas (MS) a vácuo.
Fonte: M. Groessl (2017)
Figura 3: Separação via IMS/MS de alta resolução dos fosfatos de açúcar isoméricos frutose-6-fosfato, glicose-6-fosfato e glicose-1-fosfato.
Fonte: M. Groessl (2017)
Figura 4: Esquerda: Análise via LC-MS do íon de razão m/z 259,022 apresenta apenas um único pico. Direita: Dados de IMS extraídos do LC-MS mostram claramente a presença de duas substâncias isoméricas frutose-1-fosfato e frutose-6-fosfato.
Referências bibliográficas
- M.D. Katiuska e R. Fernandez-Maestre. “Ion mobility spectrometry”. Rev. Assoc. Med. Bras. v.64 n.9. (2018).
- M. Groessl. “TOFWERK”. Application Notes. Switzerland (2017).
- N. Zanoni e J. William. “Surprising chiral composition changes over the Amazon rainforest with height, time and season”. Communications Earth & Environment. Article number: 4 (2020).
*Oscar Vega Bustillos
Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP
55 11 28105656
www.vegascience.blogspot.com.br







