A cromatografia líquida acoplada à espectrometria de massas em Tandem HPLC-MS/MS
Por Oscar Vega Bustillos*
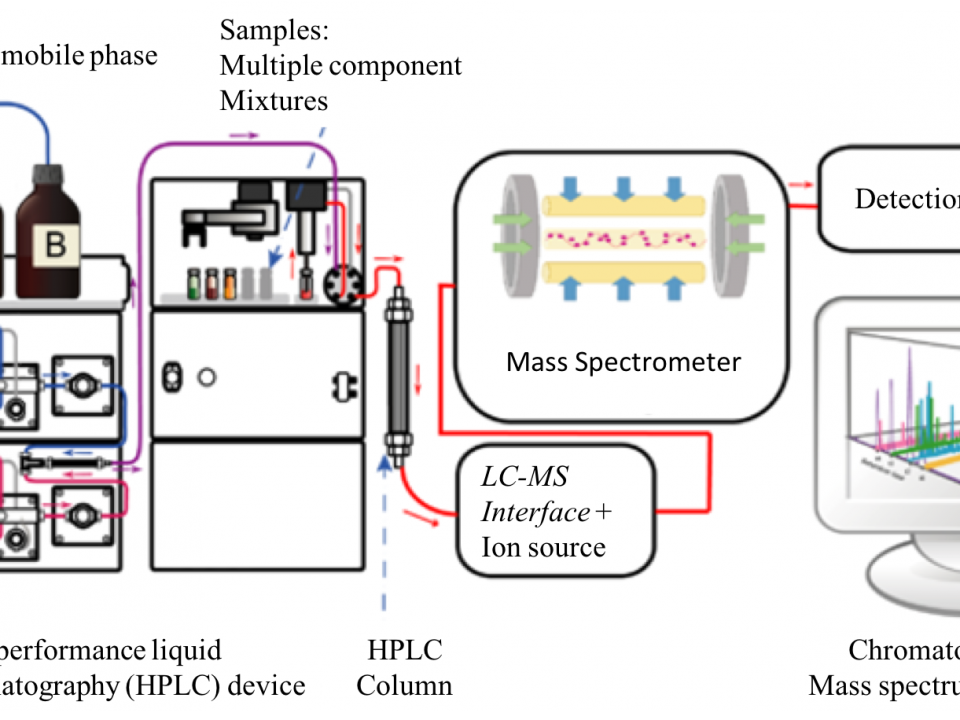
A cromatografia líquida acoplada à espectrometria de massas é, atualmente, a técnica que possibilita a análises de diversas substâncias com ampla caracterização de polaridade e massa molecular. Na cromatografia é feita a separação dos componentes de uma mistura entre duas fases: uma fixa e de grande área superficial denominada fase estacionária, e um fluido que interage com a fase fixa, chamado fase móvel. As partes principais de um cromatógrafo são bomba, o injetor, a coluna e o detector (Figura 1).
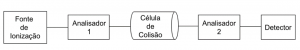
A espectrometria de massas é uma técnica para análise à nível traços, especialmente os compostos orgânicos. Entretanto, os analitos devem ser previamente ionizados. Portanto, este analisador possui, basicamente, uma fonte de ionização, analisador, detector e sistema de dados. Quando possuem dois analisadores, com uma célula de colisão entre eles, são chamados de Tandem, onde o primeiro analisador identifica o íon precursor e no segundo analisador, os íons produtos (Figura 2).
O acoplamento da cromatografia líquida LC à espectrometria de massas MS foi um processo muito complexo porque, a LC é utilizada para compostos não voláteis, sendo a fase móvel um líquido e neste estado da matéria era impossível introduzir os compostos num analisador MS que funciona à base de íons na fase gasosa. O acoplamento era mais complexo pela necessidade de eliminar o solvente líquido da eluição da coluna cromatográfica, além da LC funcionar a pressões positivas e a MS num sistema de vácuo. Muitas adaptações tecnológicas tiveram que ser desenvolvidas.
No desenvolvimento da Cromatografia Líquida de Alta Eficiência CLAE em português e “High Performance Liquid Chromatography HPLC” em inglês, foram projetadas bombas de maior pressão da fase móvel, de 50 a 350 bar, além da utilização de menores colunas cromatográficas, com diâmetros internos de 2 a 5 mm e comprimentos de 30 a 250 mm, dimensões diferentes comparadas à cromatografia líquida tradicional. Estas modificações foram necessárias para separar pequenas quantidades de amostras.
A técnica HPLC-MS abre novos caminhos para elucidar a estrutura da matéria biológica. A maior parte dos sistemas biológicos são aquoso e formados por composta não voláteis, polar e frequentemente de alta massa molecular, onde essas características impedem sua análise via GC/MS. Já a análise de tais compostos é possível via HPLC-MS. A polaridade dos compostos biológicos foi um desafio que levou ao desenvolvimento de HPLC de fase reversa. A premissa deste tipo de separação é de que os compostos orgânicos em uma fase móvel aquosa são adsorvidos preferencialmente em um material orgânico estacionário, revestida num suporte sólido. Os compostos são, então, eluídos sucessivamente, usando uma transição progressiva denominado gradiente, na composição da fase móvel, a partir da água ao orgânico, por exemplo, da água ao acetonitrilo. A ordem de eluição dos componentes da amostra é uma função das mudanças de solvente durante o gradiente. Os compostos eluem em ordem de polaridade, onde os compostos mais hidrofílicos são os primeiros. A fase estacionária é não polar em contraste com a fase polar usada na cromatografia tradicional. É por isso que o método é conhecido como de fase reversa.
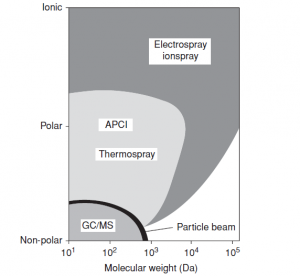
Outro desenvolvimento foi a criação de uma interfase entre o HPLC e MS, cuja função é converter o eluente da coluna, que possui os analitos, de líquido para íons na fase gasosa à pressão atmosférica, além de eliminar o solvente. Este desenvolvimento concedeu o Prêmio Nobel para John Fenn que descobriu a fonte de íons “Elestrospray Ionization ESI” (ver ANALYTICA 98). As outras interfases mais utilizadas no HPLC-MS são a Ionização Química a Pressão Atmosférica ou “Atmospheric Pressure Chemical Ionization – APCI” (ver ANALYTICA 97) e Foto Ionização a Pressão Atmosferica ou “Atmospheric Pressure Photo Ionization – APPI”. As três interfases, ESI, APCI e APPI do HPLC-MS conseguem transferir os analitos da coluna cromatográfica liquida para o interior do MS na forma de íons gasosos. Isto foi um salto enorme no desenvolvimento analítico. Na Figura 3 apresenta a capacidade analítica destas interfases em função da polaridade dos analitos e da massa molecular em Da, analisadas. Nesta figura é comparada também a capacidade analítica do GC/MS que é versátil para analitos apolares e massas menores que 1.000 Da.
No sistema HPLC-MS/MS, a amostra é introduzida pelo injetor na fase móvel e segue para a coluna contendo a fase estacionária. Na coluna, estes compostos são separados e eluídos com determinados tempos de retenção (TR) dependendo da interação entre coluna e fase móvel. Após a eluição, estes compostos são introduzidos no espectrômetro de massas na fonte de ionização, ocorrendo a ionização e evaporação do solvente. Formados os íons, estes seguem para o primeiro analisador quadrupolo, em que os íons precursores, [M+H]+ ou [M-H]–, são determinados segundo a razão massa / carga (m/z). Após a determinação m/z dos íons precursores, estes são encaminhados para uma célula de colisão, segundo quadrupolo, colidindo com o gás nitrogênio, formando fragmentos que são determinados no segundo analisador, terceiro quadrupolo. Este processo é chamado de “Multiple Reaction Monitoring MRM”, que permite o monitoramento entre os íons precursores e íons produtos selecionados, aumentando a sensibilidade nas análises.
As vantagens analíticas do desenvolvimento do HPLC-MS/MS são as seguintes:
- Aumento da gama de analitos a serem estudados desde medicamentos e metabólicos de massas em torno de 1.000 Da até biopolímeros de alta massa molecular, maiores que 100.000 Da (Figura 4).
- O MS em Tandem é o melhor detector do HPLC que permite determinar a massa molecular, além de informar a estrutura molecular, fornecendo a identificação inequívoca do analito em estudo.
- A alta seletividade do MS permite o uso de analitos marcados isotopicamente como padrões que juntamente com a alta sensibilidade, permite uma precisão e exatidão quantitativa do analito.
- O HPLC-MS/MS tornou-se uma das técnicas analíticas mais amplamente utilizadas nas ciências da vida. Análises de diferentes classes de biomoléculas: peptídeos, proteínas, ácidos nucleicos, oligossacarídeos e lipídios, estão sendo estudadas.
Fonte: Malviya, R. et al.
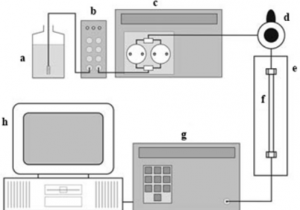
Figura 1: Esquema de um HPLC. a) Reservatório de fase móvel; b) Desgaseificador; c) Bomba; d) Injetor de amostra; e) Compartimento de coluna; f) Coluna; g) Detector; h) Processador de dados.
Fonte: Hoffmann, E., et al.
Figura 2. Esquema de um espectrômetro de massas em tandem.
Fonte: Ardrey, R.E.
Figura 3: Alternativas de ionização do HPLC-MS utilizando as interfases ESI e APCI em função da polaridade do analito e da massa molecular (Da). Comparação com o analisador GC/MS.
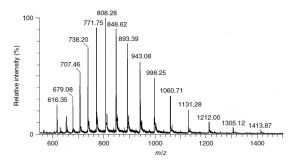
Fonte: Ardrey, R.E.
Figura 4: Espectro de massas da mioglobina do coração do cavalo via HPLC-MS/MS com fonte Electrospray.
Referências bibliográficas
- Hoffmann, E. and Stroobant, V. “Mass spectrometry. Principles and applications.” Ed. John Wiley. England. 2007.
- Ardrey, R.E. “Liquid chromatography – Mass spectrometry: An introduction.” Ed. John Wiley. England. 2003.
- Malviya, R.; Bansal, V.; Pal, O. P.; Sharma, P. K. (2010). “High performance liquid chromatography: a short review”. Journal of Global Pharma Technology. 2: 2226. 2010.

*Oscar Vega Bustillos
Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP
55 11 3133 9343
www.vegascience.blogspot.com.br
[[Artigo disponível na íntegra na Revista Analytica Ed 106]]


