O início da cromatografia pelo botânico russo Tswett em 1903 foi baseado em cromatografia em fase
líquida (LC). A cromatografia em fase gasosa (GC) teve o seu desenvolvimento em 1952. Já a
cromatografia com fase fluido supercrítico (SFC) começou a ser usada em 1962.
O objetivo desse artigo é mostrar as diferenças, as aplicações e as vantagens entre as três
cromatografias LC, GC e SFC.
A tabela 1 mostra a evolução histórica da cromatografia.
Tabela 1: Evolução cronológica da cromatografia liquida, gasosa e supercrítica.
Apesar da cromatografia ter seu início com colunas grandes de vidro onde a fase móvel era um líquido
(LC) a primeira grande evolução em direção a instrumentação moderna foi em GC. Isso aconteceu
porque a indústria petroquímica precisava separar e analisar as frações voláteis como gasolina e diesel.
Em 1952 a cromatografia de partição foi descrita e começou a ser usada em análise de processos e
foram construídos os primeiros GCs comerciais usando o detector TCD. A instrumentação de GC é mais
simples porque não precisa de bomba de fase móvel, basta ter um gás de arraste pressurizado e ajustar
o fluxo na coluna. Além disso, precisa de coluna aquecida num forno, um detector TCD e um sistema de
registro do cromatograma.
A LC moderna foi descrita em 1969, mas a instrumentação moderna como conhecemos hoje, demorou
para ser desenvolvida e se tornar confiável e robusta. Entre os anos de 1980 e 1990 ela se tornou bem
conhecida e ganhou fama e o nome de HPLC, (High Performance Liquid Chromatography).
Já a SFC foi descrita pela primeira vez por Ernst Klesper em 1962 e também sofreu os mesmos
problemas iniciais da HPLC, falta de instrumentação adequada e confiável. Somente a partir de 1992
começou a produção comercial do SFC baseado na plataforma de um GC com colunas capilares ou
empacotadas.
Antes de compararmos as três técnicas cromatográficas GC, HPLC e SFC, precisamos entender o que elas
têm em comum. Apesar de existirem outros processos de separação como a adsorção, troca iônica,
separação por tamanho, as três técnicas de separação GC, HPLC e SFC usam praticamente o mesmo
processo de partição para separar os compostos na coluna.
A partição usa uma fase estacionaria liquida que é depositada na coluna de separação e quando a
amostra é transportada na coluna pela fase móvel, esse composto pode ou não se dissolver nesse
líquido da fase estacionaria. Se esse líquido da fase estacionaria for quimicamente similar a amostra, ele
consegue solubilizar por alguns instantes e depois ele volta para a fase móvel.
Esse processo de partição entre a fase móvel e fase estacionaria ocorre muitas e muitas vezes na coluna,
dissolvendo na fase estacionaria e voltando para a fase móvel. Quanto maior a similaridade química do
composto com a fase estacionária, mais ela interage nesse líquido e mais ela demora para atravessar
coluna.
Os compostos sem afinidade química com esse líquido da fase estacionária passam reto com a fase
móvel e são os primeiros e sair da coluna. Assim funciona a separação por partição.
A regra básica na separação por partição é semelhante dissolve semelhante. Se quer separar compostos
polares use uma fase estacionária polar.
O que muda nas colunas cromatográficas usadas em GC, HPLC e SFC é o modo como se deposita a fase
estacionaria na coluna.
A figura 1 mostra uma coluna capilar geralmente usada em GC, a fase liquida estacionaria é depositada e
presa nas paredes internas do tubo de sílica fundida.

Figura 1: Coluna capilar de sílica fundida usada em GC com a camada de poliimida externa, o vidro de
sílica no meio e internamente uma camada de fase estacionaria presa e ligada ao vidro do tubo.
As colunas usadas em HPLC são empacotadas com microesferas de sílica e a fase estacionaria liquida é
impregnada e presa no interior e na superfície dessas microesferas. Essas partículas têm muitos poros
por onde a fase móvel arrasta a substância para o interior da partícula e onde o processo de partição
ocorre.
Quanto maior a área superficial dessas partículas, maior será a partição nessa coluna. A figura 2 ilustra
uma coluna empacotada de LC onde dois compostos A e o B são separados por partição nas
microesferas empacotadas dessa coluna.
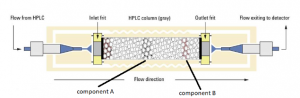
Figura 2: Coluna micro empacotada usada em HPLC.
Essas micro esferas podem ser observadas na figura 3 com a partícula totalmente porosa com 1,8 um de
tamanho e a partícula com núcleo solido e partículas superficiais.
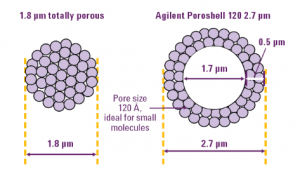
Figura 3: Partículas usadas no empacotamento das colunas de HPLC modernas com núcleo totalmente
poroso e núcleo sólido.
Em SFC as colunas podem ser as capilares de sílica fundida usadas em GC e as empacotadas usadas em
HPLC, ou seja, não tem colunas especificas de SFC porque elas se situam entre as duas cromatografias
GC e HPLC.
A fase móvel usada para transportar a molécula pela coluna é o que define o tipo de cromatografia, e
pode ser GC, HPLC ou SFC.
GC usa sempre um gás como fase móvel e esse gás geralmente é o hidrogênio, nitrogênio ou hélio.
Nesse caso a fase móvel não interfere na separação e deve somente transportar as moléculas que estão
em fase gasosa. As aplicações em GC dependem da capacidade da molécula sobreviver e não degradar
por temperatura.
HPLC usa sempre um líquido como fase móvel. Para um composto poder ser analisado por HPLC ele
precisa primeiramente ser solúvel na fase móvel.
Os líquidos ou fases moveis mais usados em HPLC são água, metanol, acetonitrila, isopropanol e hexano.
Geralmente à esses líquidos são adicionados uma pequena quantidade de modificadores que podem
mudar o pH ou a eficiência dessa fase móvel para solubilizar melhor os analitos de interesse.
Diferente de GC, em HPLC a fase móvel influencia na eluição e separação cromatográfica. Então, temos
em HPLC duas variáveis para otimizar a separação que é a fase móvel e a fase estacionária.
Se o solvente da fase móvel conseguir solubilizar bem o composto analisado, esse composto vai ficar
mais tempo na fase móvel que na fase estacionaria e eluir rapidamente. Se a capacidade de solubilizar
da fase móvel for ruim, o composto vai particionar mais e ficar mais tempo na fase estacionaria e atrasar
esse composto na coluna.
SFC não usa nem um gás nem um líquido como fase móvel. A fase móvel é uma substância que está
entre a fase líquida e a fase gasosa, descrito como um fluido supercrítico.
O diagrama de fases da figura 4 mostra como se comporta o dióxido de carbono (CO2) em diferentes
temperaturas e pressões. O ponto triplo é onde numa dada temperatura e pressão as fases gasosa,
liquida e sólida coexistem.
Acima desse ponto triplo começa existir uma linha que separa a fase gasosa e a fase liquida do CO2.
Mas, acima de 31°C e 74 bar essa linha desaparece e a partir desse ponto crítico temos o CO2 em estado
de fluido supercrítico.
Nesse estado de fluido supercrítico, o CO2 tem a densidade próxima de um líquido, mas com
viscosidade e coeficiente de difusão próximas a um gás. Essas três características são o grande atrativo
para a SFC. A alta densidade permite solubilizar melhor e ajuda a partição na coluna. A viscosidade e
difusão próximas a um gás permitem análises mais rápidas e menor alargamento de pico mesmo com
colunas empacotadas.
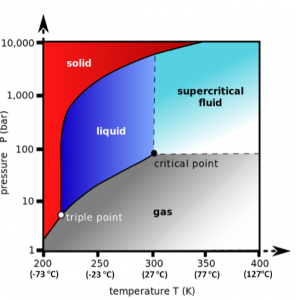
Figura 4: Diagrama de fases entre o gás, o líquido, o sólido e o fluido supercrítico.
O CO2 usado para SFC pode ser fornecido por cilindros regulares de CO2 líquido com tubo pescador.
A água é um excelente solvente para cromatografia, mas seu ponto crítico no diagrama de fases é de
374°C e a pressão de 227 bar. Essas condições inviabilizam o uso que água como fase móvel em SFC.
O CO2 por ter ponto crítico mais baixo é fácil de ser usado e tem outras vantagens como ser inerte, não
ser tóxico em fase gasosa e um pouco miscível com água. A desvantagem do CO2 é que ele é bem apolar
e podemos dizer que equivalente ao heptano em termos de polaridade.
Para suprir essa falta de solubilidade na fase móvel para compostos mais polares em SFC são
adicionados os modificadores de fase móvel e como exemplo mais usado o metanol. As quantidades de
metanol adicionadas na fase móvel são baixas e em torno de 1 a 10% no CO2. Elas podem ser pre-
misturadas ao CO2 ou adicionado com uma bomba regular de HPLC como se fosse um gradiente.
É claro que como em HPLC, outros modificadores e sistemas terciários de gradiente também são usados
em SFC.
A figura 5 mostra que para qualquer geometria de coluna empacotada, qualquer tamanho de partícula e
k’, o SFC sempre tem a vantagem de ser mais rápido em relação ao HPLC.
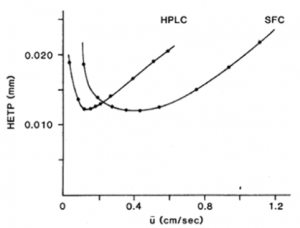 Figura 5: Curvas de eficiência de separação para HPLC e SFC em função da velocidade da fase móvel.
Figura 5: Curvas de eficiência de separação para HPLC e SFC em função da velocidade da fase móvel.
Com relação a instrumentação de SFC o primeiro SFC comercializado em 1992 foi montado num GC
HP5890 e usava colunas capilares de sílica fundida. O detector era o tradicional de GC por ionização de
chama (FID).
Para funcionar o SFC é necessário manter a temperatura e a pressão acima da crítica ao longo de toda a
coluna. Mesmo produzindo uma pressão no começo da coluna capilar, é preciso garantir que essa
pressão fique igual até o final da coluna.
Para manter a pressão na coluna é usado no final da coluna capilar de 250 microns um restritor capilar
que é um tubo com diâmetro interno entre 10 a 50 microns. Esse restritor precisa ser aquecido porque o
CO2 ao sair desse capilar se expande e resfria o restritor e pode chegar a entupir se não for aquecido.
O SFC moderno usa o hardware do HPLC e colunas empacotadas convencionais de C18 ou C8 de fase
reversa.
O SFC moderno é composto de uma bomba de CO2 resfriada, uma bomba convencional para o
modificador, compartimento de coluna, injetor automático e o detector DAD.
A célula de detecção do DAD precisa suportar altas pressões, não pode ser uma célula convencional.
Além disso, precisa também manter essa pressão acima do ponto crítico ao longo da coluna e detector.
Para manter essa pressão atualmente usa-se uma válvula automática e aquecida após o detector.
As vantagens de SFC em relação ao HPLC são:
– O SFC é três a cinco vezes mais rápido que o HPLC
– Um terço a um quinto de redução de pressão no SFC em relação ao HPLC
– O SFC é uma técnica ortogonal ao HPLC de fase reversa
– O SFC tem menor custo de operação em relação ao HPLC
– O SFC é uma técnica verde e pode reciclar o CO2. Não usa acetonitrila e usa menos modificadores.
Em relação as aplicações de SFC, é comum falar que é a técnica preferida para a separação de
compostos quirais. Além disso existem inúmeras aplicações de SFC e a ideia é preencher a lacuna entre
o GC e o HPLC.
A recomendação de leitura sobre SFC, para saber mais sobre aplicações e usos, está no livro com 186
páginas em PDF chamado de “Supercritical Fluid Chromatography Primer” no link:
https://www.agilent.com/cs/library/primers/public/5991-5509EN.pdf
Encontre mais informações sobre LC no livro com 200 páginas em pdf chamado de “The LC Handbook”.
Esse livro fala sobre as colunas de LC e desenvolvimento de métodos. Link:
https://www.agilent.com/cs/library/primers/public/LC-Handbook-Complete-2.pdf
Para GC, tem um arquivo em PDF de 60 paginas sobre os fundamentos básicos de GC no link:
https://www.agilent.com/cs/library/usermanuals/public/G1176-90000_034327.pdf
A conclusão é que onde o GC e o HPLC funcionam bem, o SFC ainda não tem muito sentido porque ele é
pouco conhecido e não cobre todas as aplicações. Se tiver dificuldade com uma molécula em analisar
por GC ou por HPLC, então o SFC é a solução.
Autor: Celso Blatt, Ph.D. | Agilent Technologies Brasil
**************************************************************************************************************************************************************************

Confira muito mais em nossa revista digital:
CLIQUE AQUI!







