O espectro de massas na espectrometria de massas
Por Oscar Vega Bustillos
O espectro de massas é a representação gráfica de uma análise química processada por um espectrômetro de massas. O espectro depende da forma como foi ionizado o analito dentro da “Fonte de íons”, se foi via ionização por impacto de elétrons EI, ionização química CI, eletro nebulização ESI, MALDI, ICP entre outros. Também depende do “Analisador” utilizado, se foi quadrupolo, eletromagnético ou TOF e finalmente depende também do “Detector de íons”, se foi copo de Faraday, multiplicador de íons, fotomultiplicadora ou multicanal. Certamente a escolha destas opções está relacionada à análise química que o analista deseja. Geralmente é escolhida tendo como base a análise química orgânica, inorgânica ou isotópica.
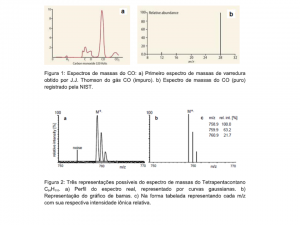
O primeiro espectro de massas de varredura foi desenhado por J.J. Thomson. Ele estava insatisfeito com seu método fotográfico de registro das parábolas. O problema era que as espécies iônicas leves penetraram profundamente no filme fotográfico, causando uma quantidade desproporcional de escurecimento e os íons mais pesados causavam um efeito contrário, tornando as estimativas quantitativas das intensidades do feixe de íons, impraticáveis. Ele resolveu esse problema construindo uma fenda no tubo onde o filme fotográfico normalmente ficava. Atrás dessa fenda instalou um copo de Faraday que coletava a carga iônica. A intensidade da carga foi estimada observando o tempo que um eletroscópio carregado, levava para descarregar. Mudando lentamente o campo magnético, os feixes de íons podiam ser posicionados, um de cada vez, na fenda e suas intensidades registradas. A partir destes resultados, ele plotou a intensidade dos íons em relação à massa relativa. Desta forma Thomson inventou o primeiro espectrômetro de massa de varredura do mundo. Ele decidiu registrar os espectros de massas de alguns compostos químicos. Assim, analisou o CO ligeiramente impuro. Este espectro de massas é mostrado na Figura 1a. Observe o pico abundante da molécula de CO, junto com os picos menores de m/z 12 (carbono) e m/z 16 (oxigênio), uma combinação surpreendentemente igual com a versão do gráfico de barras da NIST (Figura 1b). Thomson escreveu uma monografia em 1913 sobre este tema: “Rays of positive electricity and their application to chemical analyses”. Neste trabalho ele demonstrou uma grande variedade de compostos químicos que podem ser analisados pela espectrometria de massas e encorajou seus colegas da química a adotar a técnica como uma ferramenta analítica. Tornando a espectrometria de massas uma ferramenta indispensável na química analítica.
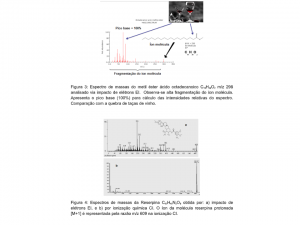
O espectro de massas é representado num gráfico cartesiano bidimensional, onde a intensidade do sinal iônico é denotada pela ordenada (eixo-y) e a razão m/z do íon fica localizada na abcissa (eixo-x). A posição de um pico, com uma determinada razão m/z no gráfico, representa a criação de um íon a partir do analito dentro da fonte de íons. A intensidade desse pico representa a abundancia deste determinado íon neste local. Na Figura 2 é ilustrado o espectro de massas da molécula Tetrapentacontano C54H110 de três formas diferentes, uma via perfil do espectro real demonstrada na forma de curvas gaussianas, a segunda via representada pelo gráfico de barras e a terceira na forma tabelada representando cada m/z com sua respectiva intensidade iônica relativa. O pico do íon molecular M+•, isto é a molécula do analito ionizada sem fragmentação é geralmente acompanhada por vários picos de m/z inferiores causados pela fragmentação do íon molecular (Figura 3). Para algumas moléculas, como o CO, o pico em m/z mais alto representa a molécula ionizada intacta (Figura 1b). Para analitos com ligações químicas muito fracas, o efeito é, ao contrário, com alta fragmentação e o pico do íon molécula pequeno ou até sumido (Figura 3). Consequentemente, os respectivos picos no espectro de massa podem ser referidos como picos do íon fragmentado. Este efeito tem suas vantagens, pois facilita a reconstrução da estrutura molecular do analito (Figura 4a). O pico mais intenso de um espectro de massa é chamado de pico base. Na maioria das representações de dados espectrais de massa, a intensidade do pico base é normalizada para 100% de intensidade relativa. Isso ajuda muito a tornar os espectros de massa mais facilmente comparáveis (Figura 3).
Uma analogia para entender isso é imaginar o espectro de massas da Figura 3 com uma bandeja cheia de taças de vinho. Se esta bandeja cair no chão (ionização EI), quebrando a maioria de taças de vinho, a maior parte dos cacos de vidro pertence à boca das taças, por ser uma ligação de vidro muito débil, fácil de quebrar, ao contrario haverá um número significativo da base das taças por possuírem um vidro mais coeso, difícil de quebrar. Algumas taças estarão intactas, mas serão muito poucas as que não quebraram, estas representam o íon molécula.
Várias formas iônicas podem ser observadas num espectro de massas. Se o analito é ionizado via EI, o mesmo permanece intacto após a ionização e no modo positivo, é observado o íon, [M] +. Se o analito é ionizado via CI, o íon será formado pela adição de um próton ao analito para formar uma molécula protonada, [M+H] +. Outros adjuntos moleculares podem ser formados dependendo do método da ionização, por exemplo, [M+Na] + e [M+K] + em ESI, enquanto [M+C2H5] + e [M+NH4] + ocorrem em CI, dependendo do gás reagente. Na ionização negativa, os íons gerados incluem aqueles formados pela aquisição de um elétron, [M]–, a perda de um próton, [M-H]–, ou a adição de um halogênio ou outro íon negativo, por exemplo, [M+Cl] – e [M+CH3COO] –. Como exemplo é apresentado na Figura 4 o espectro de massas do alcaloide Reserpina C33H40N2O9 obtida por impacto de elétrons EI e por ionização química CI utilizando metano como gás reagente. Observa-se alto grau de fragmentação do íon molécula m/z 608 no espectro por EI já que envolve elevadas energias de ionização (70eV) e baixa fragmentação no espectro de CI, chamada por isso de “soft ionization” envolvendo energias em torno de 5eV. O íon molécula protonado [M+1] é representado pela razão m/z 609 na ionização CI. A vantagem desta ionização é ser muito mais seletiva que a EI onde a fragmentação é plena. Um exemplo deste tipo de ionização é o estudo dos compostos orgânicos voláteis (COVs) realizados pelo espectrômetro de massas denominado Proton Transfer Reaction Mass Spectrometry, PTR-MS que utiliza como gás reagente água formando o íon hidrônio H3O+.
Há um grande impacto no padrão de isótopos num espectro de massas, especialmente quando um analito inclui certos heteroátomos. Entre os elementos comumente encontrados exibindo padrões de isótopos distintos estão, o cloro, onde a proporção isotópica 35Cl e 37Cl é 3:1, e do bromo, onde a proporção de 79Br a 81Br é 1:1. Há uma separação de 2 Da entre os isótopos para ambos os elementos. Outro importante uso dos perfis de isótopos num espectro de massas é utilizado quando C, H, N e O são analisados. Estabelecendo o número de átomos de carbono em uma molécula. A abundância natural de 13C é 1,1% maior que 12C; ou seja, há 1,1% de chance de que qualquer carbono em uma molécula será um 13C, portanto, o número de átomos de carbono pode ser determinado a partir de a intensidade do íon M+1. Por exemplo, uma intensidade de 22% para 13C indica que há 20 átomos de carbono nessa espécie.
Referências bibliográficas
- J.H. Gross. “Mass spectrometry”. Ed. Springer. 2011.
- J. Greaves and J. Roboz. “Mass spectrometry for novice”. CRC Press. 2014.
- O.Vega, A.Sassine and R.March. “A espectrometria de massas quadrupolar”. Scortecci. 2003.
*Oscar Vega Bustillos
Pesquisador do Centro de Química e Meio Ambiente CQMA do Instituto de Pesquisas Energéticas e Nucleares IPEN/CNEN-SP
55 11 28105656
www.vegascience.blogspot.com.br







